Descubrimientos revolucionarios sobre las nuevas características de la variante ómicron y un anticuerpo JMB2002 antiómicron
SHANGHÁI, 3 de enero de 2022 /PRNewswire/ — Los resultados de investigaciones conjuntas del Centro de Biología de Jemincare y el Instituto de Materia Médica de Shanghái (SIMM) de la Academia China de Ciencias (CAS) confirmaron que JMB2002, un anticuerpo neutralizante (NAb) antiSARS-CoV-2 descubierto por el Centro de Biología de la empresa Jemincare, sigue siendo efectivo contra la variante ómicron del SARS-CoV-2.
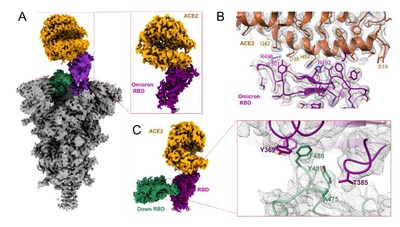
Un equipo de científicos dirigido por el Dr. Su-Jun Deng, del Centro de I+D de Biología de Jemincare, y otro equipo de científicos del instituto SIMM de la academia CAS, dirigido por el profesor H. Eric Xu y el Dr. Wanchao Yin, no solo confirmaron la actividad de unión y neutralización de pseudovirus del anticuerpo JMB2002 contra la variante ómicron, sino que también disolvieron las estructuras de la proteína de espiga de la variante ómicron en el complejo de unión con el receptor ACE2 y el anticuerpo JMB2002, respectivamente (figura 1 y figura 2). Los esfuerzos conjuntos de investigación revelaron los mecanismos de mayor infectividad y escape inmune de la variante ómicron a nivel molecular, y demostraron el mecanismo único de unión de JMB2002 que difiere de todos los anticuerpos neutralizantes (NAb) informados. Las conclusiones detalladas de las nuevas características de la variante ómicron y el anticuerpo JMB2002 se publicaron en el sitio web de preimpresión de bioRxiv (referencia 1).
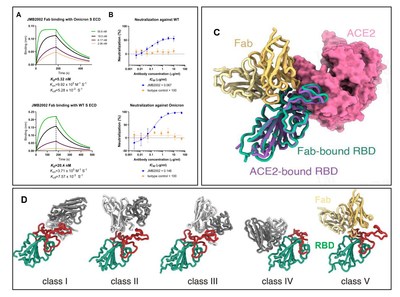
Los últimos resultados de la investigación indicaron que JMB2002 presenta una alta actividad de unión a la variante ómicron y mostró una potente función neutralizante del pseudovirus ómicron (Figuras 2A y 2B). Es alentador considerar que la mayoría de los fármacos de anticuerpos neutralizantes del SARS-CoV-2 aprobados y en etapa clínica han perdido su actividad neutralizante o han demostrado una reducción significativa de la potencia de neutralización debido a las múltiples mutaciones de la proteína espiga en la variante ómicron.
Una razón que respalda la mayor infectividad de la variante ómicron es que el dominio de unión al receptor (RBD) de su proteína espiga presenta una mayor capacidad de unión al receptor ACE2 del SARS-CoV-2 que la del tipo silvestre. Existen necesidades inmediatas de desarrollar anticuerpos terapéuticos específicos dirigidos a la variante ómicron. Los científicos de Jemincare descubrieron que la afinidad de unión del fragmento de unión a antígeno (Fab) del anticuerpo JMB2002 a la proteína espiga de la variante ómicron es 4 veces mayor que a la de la variante de tipo salvaje (WT) (Figura 2A). Lo que es más importante, el grupo del profesor H. Eric Xu ha resuelto la estructura del complejo de trímero de la proteína espiga de la variante ómicron unida a JMB2002 (Figura 2C). La estructura muestra que el anticuerpo JMB2002 se une a la parte posterior del dominio RBD, un epítopo de unión único que presenta una nueva conformación (Figura 2D). Se indica que el JMB2002 es una nueva clase de anticuerpo neutralizante del SARS-CoV-2 con un mecanismo de unión diferente de todos los NAb reportados y se clasifica como NAb clase V. Los resultados del ensayo de neutralización de pseudovirus indican que JMB2002 es un anticuerpo neutralizante de amplio espectro dirigido a todas las variantes de preocupación de la OMS excepto la delta (referencia 1).
JMB2002 finalizó el ensayo clínico de Fase I en China
En junio de 2021, terminó el ensayo clínico de Fase I realizado con JMB2002 en donantes sanos en China y demostró excelentes niveles de seguridad y propiedades farmacocinéticas (PK) deseables. En marzo de 2021, JMB2002 fue aprobado para realizar un ensayo clínico en los Estados Unidos (IND 154745). En la actualidad, Jemincare ha producido suficiente sustancia farmacológica de anticuerpo JMB2002 para llevar a cabo una investigación clínica posterior a escala de biorreactor de 2000 l.
Acerca de Jemincare Group Co., Ltd.
Como una de las empresas farmacéuticas más reconocidas de China, Jemincare se ha enfocado en ofrecer medicamentos de alta calidad a los pacientes y ha ocupado el primer lugar entre las 100 principales empresas farmacéuticas chinas durante años. Jemincare estableció su Centro de I+D en la ciudad científica de Shanghái Zhangjiang desde 2018 y ha contratado a más de 500 científicos. El Centro de I+D ha desarrollado plataformas tecnológicas innovadoras de productos biológicos, moléculas pequeñas y nuevos sistemas de administración de medicamentos, entre otros, y se dedica a desarrollar terapias innovadoras para enfermedades renales, tumores, enfermedades cardiovasculares y cerebrovasculares, enfermedades respiratorias, infecciones, pediatría y manejo del dolor.
Para obtener más información, visite: www.jemincare.com
O contacte a: PR@jemincare.com
Referencia
1. Structures of the Omicron spike trimer with ACE2 and an anti-Omicron antibody: mechanisms for the high infectivity, immune evasion and antibody drug discovery, (“Estructuras del trímero de la proteína espiga de la variante ómicron con el receptor ACE2 y un anticuerpo antiómicron: mecanismos para la alta infectividad, la evasión inmunológica y el descubrimiento de fármacos de anticuerpos”), https://doi.org/10.1101/2021.12.27.474273.
Foto – https://mma.prnewswire.com/media/1718766/1.jpg
Foto – https://mma.prnewswire.com/media/1718767/2.jpg
FUENTE Jemincare

Leave a Reply
You must be logged in to post a comment.